Pharmazeutische Bioanalytik
Physikalische Reize, chemische Noxen und vor allem Pathogene stellen Ursachen für Entzündungsprozesse dar. Bei diesen körpereigenen Abwehrreaktionen werden verschiedene Signalwege und Kaskaden aktiviert und eine Reihe an diversen Mediatoren wie Zytokine, Peptide, Rezeptormoleküle und Lipidmediatoren (LM) gebildet und freigesetzt. Ziel dieser akuten Immunreaktionen ist es, den Gleichgewichtszustand im Gewebe, die Homöostase, wiederherzustellen und somit die Entzündung aufzulösen. Gelingt dem Immunsystem dies nicht, entwickeln sich chronische Entzündungen, welche ursächlich für eine Reihe von Krebserkrankungen sein können.
Die Arbeitsgruppe um Prof. Garscha beschäftigt sich verstärkt mit der Biosynthese von entzündlichen (z.B. Leukotriene, Prostaglandine) und anti-entzündlichen (z.B. Resolvine, Protectine) LM im pathogeninduzierten Entzündungsgeschehen. Dabei sollen molekulare Mechanismen identifiziert werden, welche die Imbalance im LM-Netzwerk hervorrufen. Biosynthetisch involvierte Proteine der Arachidonsäurekaskade werden strukturell charakterisiert und als potentielle Targets bestätigt. Gut validierte Testsysteme und die stetige Verbesserung dieser ermöglichen es uns Naturstoffe, aber auch synthetisch erzeugte Verbindungen auf ihre zelluläre anti-entzündliche Wirkung zu charakterisieren. Hierbei kommen molekularbiologische Methoden wie rekombinante Expression, zielgerichtete Mutation, PCR, aber auch andere biochemische Analysemethoden wie Immunofluoreszenzmikroskopie zum Einsatz. Die qualitative und quantitative Analyse der LM erfolgt über HPLC, LC-MS/MS und superkritische Fluidchromatographie.
Projekte
Pathogen-induzierte Lipidmediatorbiosynthese
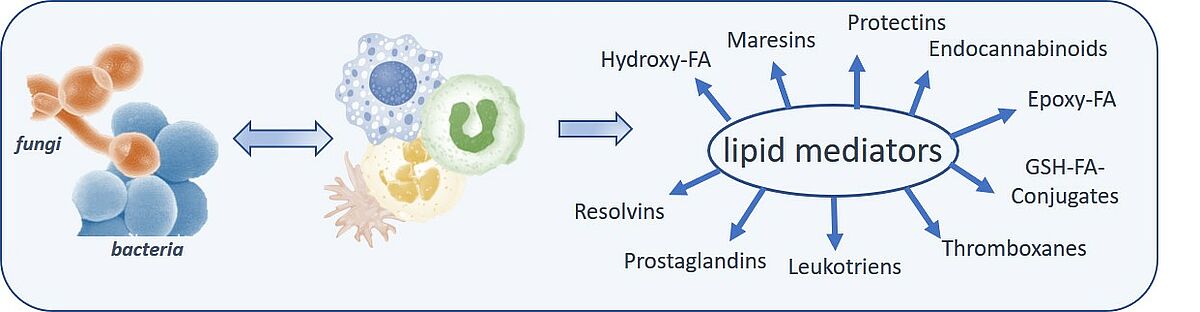
In diesen Projekten untersuchen wir die LM-Biosynthese in primären humanen Blutzellen (Neutrophile, Makrophagen, Monozyten, Thrombozyten) nach Pathogeninteraktion. Pathogen-spezifische Virulenzfaktoren (z.B. von Staphylococcus (S.) aureus, Streptococcus (S.) pneumoniae, Pseudomonas aeruginosa, Candida (C.) albicans) und zelltypische Aktivierungsmechanismen sollen hier identifiziert und charakterisiert werden.
Einfluss des 5-Lipoxygenase-aktivierenden Proteins (FLAP) auf die Leukotrienbildung und andere zelluläre Prozesse
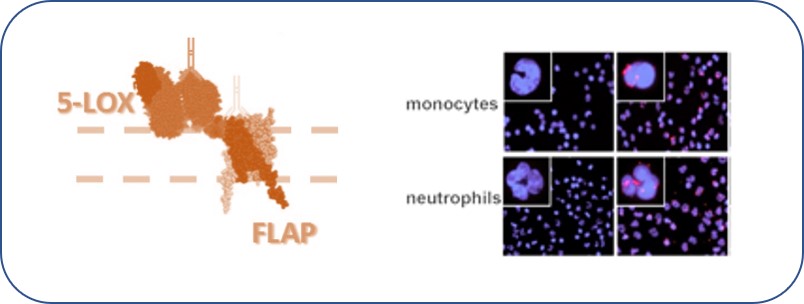
FLAP, ein kernmembranständiges Protein der MAPEG*-Familie, wurde als MK-886 bindendes Protein identifiziert und ist essentiell für die zelluläre Leukotrienbildung während der Immunantwort. Dabei bildet es zusammen mit dem Arachidonsäure-metabolisierenden Enzym 5-Lipoxygenase (LOX) einen biosynthetischen Komplex, der Vorrausetzung für die Leukotrienbildung ist. Schwerpunkte dieses Projektes sind die Charakterisierung des Komplexes, die Sicherstellung der Interaktionsstelle als potentielle Wirkstoffbindungsdomäne und die Identifizierung weiterer FLAP-abhängiger zellulärer Prozesse. (*Membrane-Associated Proteins in Eicosanoid and Glutathione metabolism)
Entwicklung neuartiger FLAP-Inhibitoren und dualer sEH/FLAP-Inhibitoren
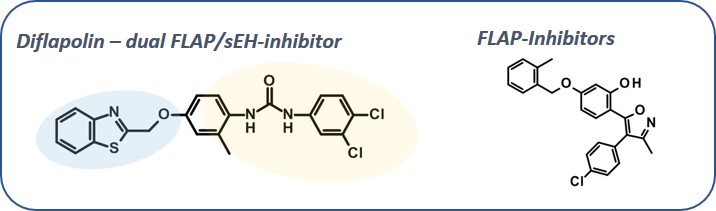
Zusammen mit verschiedenen internationalen Kooperationspartnern suchen wir nach neuen pharmakokinetisch günstigen FLAP-Inhibitoren. Verstärkt widmen wir uns aber auch dem Design dualer Hemmstoffe, welche die lösliche Epoxidhydrolase (sEH) und FLAP, und damit zwei Zweige der Arachidonsäurekaskade inhibieren. Ziel ist es, potente, anti-inflammatorische Arzneistoffe mit günstigem pharmakokinetischen Potential und geringen Nebenwirkungen zu entwickeln.
Identifizierung und Charakterisierung neuartiger LM und pathogenspezifischer Oxylipine
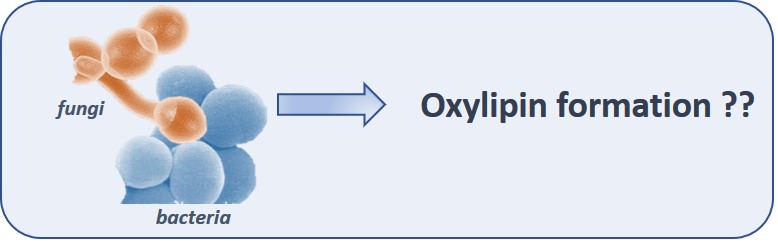
Neben den bekannten LM, die in humanen Zellen nach Pathogeninteraktion gebildet werden, biosynthetisieren auch die Pathogene selbst oxygenierte Lipide, genannt Oxylipine. Diese sind wenig untersucht oder oft noch gar nicht identifiziert. Ziel dieses Projektes ist es z.B. C. albicans auf dessen Oxylipinbiosynthese zu untersuchen, eventuell neue Oxylipine zu identifizieren und ihre Biosynthesewege zu entschlüsseln.
Etablierung neuer Methoden zur Enantiomerentrennung verschiedener Arzneistoffe mittels SFC
Mit Hilfe der Superkritischen Fluidchromatographie (SFC) sollen neue Methoden entwickelt und validiert werden, um z.B. schwer zu trennende Enantiomere verschiedener Arzneistoffe zu diskriminieren. Die als „grüne“ Methode bekannte und durch kurze Analysezeiten gekennzeichnete SFC eignet sich besonders für lipophile Analyten, welche durch herkömmliche HPLC schlecht zu analysieren sind.
