Forschung


Alg4Nut
Im Verbundprojekt "Alg4Nut" wird der Einfluss von im Ostseeraum kultivierbaren Meeresalgen auf die Tiergesundheit erforscht. Das Teilprojekt der Abteilung Pharmazeutische Biotechnologie an der Universität Greifswald umfasst die Untersuchungen des Pansenmikrobioms und bakterieller Strategien zur Verwertung von Algenpolysacchariden. Darüber hinaus trägt das Greifswalder Teilprojekt zur Entwicklung neuer biotechnologischer Produktionsstämme bei.
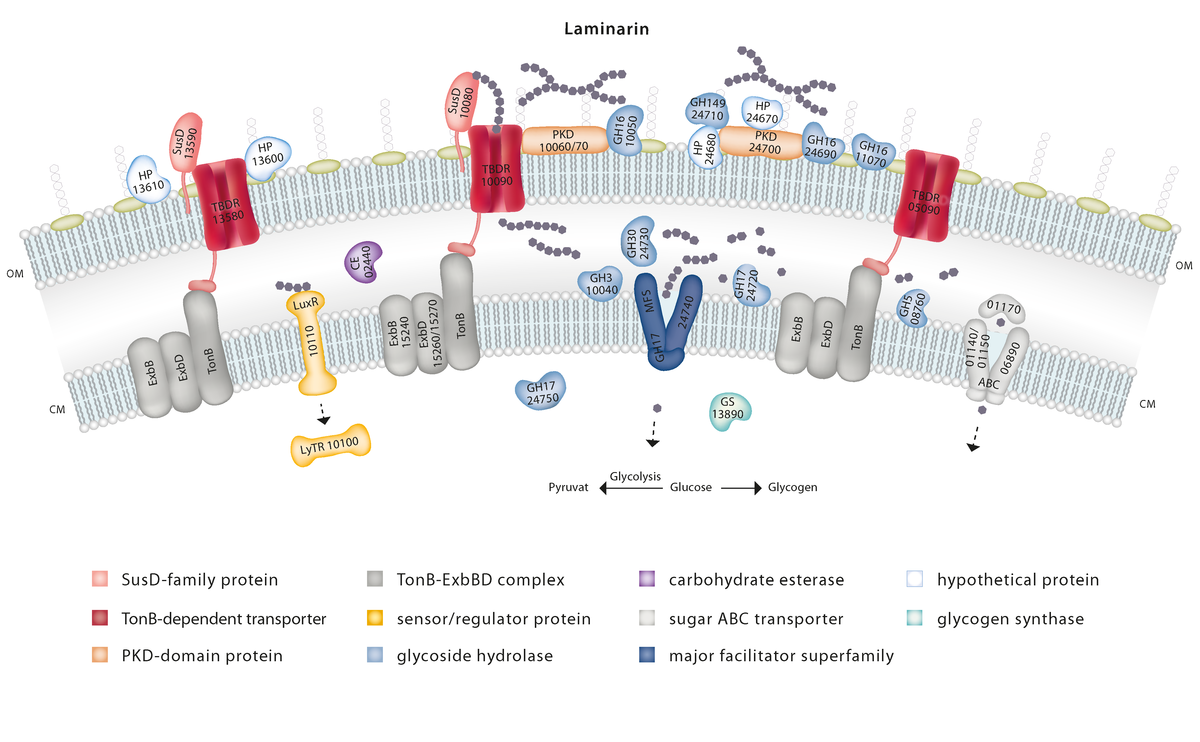
Molekulare Mechanismen des marinen Polysaccharidabbaus
Algenblüten, d. h. eine massive Vermehrung von Algen in marinen Ökosystemen, werden durch jahreszeitlich bedingte Veränderungen der Umweltbedingungen und durch Nährstoffeinträge der extensiven Landwirtschaft verursacht. Große Mengen an Algenbiomasse wirken sich nachteilig auf die Küstenökosysteme, den Tourismus aber auch Aquakulturen aus. Gleichzeitig stellen sie eine bislang noch unzureichend genutzte, nachhaltige Ressource für seltene marine Zucker dar. Das komplexe Spektrum an Nährstoffen, das von Algen freigesetzt wird, bietet Bakterien einen fruchtbaren Nährboden. Diese Nährstoffe umfassen strukturell vielseitige Algenpolysaccharide. Um diese teilweise widerspenstige Nahrungsquelle zu erschließen, verfügen Bakteriengemeinschaften über ein vielfältiges Repertoire an hochspezialisierten Enzymen, substratbindenden Proteinen und Transportern. Interessanterweise verfolgen einzelne Bakterien ganz unterschiedliche Strategien, um diese Algeninhaltsstoffe zu verwerten, sich gegen Nahrungskonkurrenten durchzusetzen oder voneinander zu profitieren. Mit diesen bakteriellen Strategien beschäftigt sich unsere DFG-Forschungsgruppe POMPU (FOR 2406; www.pompu-project.de).
Mikrobielle Interaktionen und Wirkstoffe in marinen Symbiosen
Alle höheren Organismen sind mit Mikroorganismen verbunden. Die Koexistenz dieser verschiedenen Partner und die Wechselwirkungen zwischen Wirt und Mikrobe sind von entscheidender Bedeutung für das Leben auf der Erde. Detaillierte Kenntnisse der mikrobiellen Physiologie und der molekularen Interaktionsmechanismen sind daher für das Verständnis biologischer Prozesse unerlässlich. Bakterielle Symbionten erfüllen vielfältige Aufgaben: Sie versorgen ihre Wirte mit Nährstoffen, ermöglichen den Zugang zu unwirtlichen Lebensräumen oder produzieren antimikrobielle bioaktive Verbindungen.
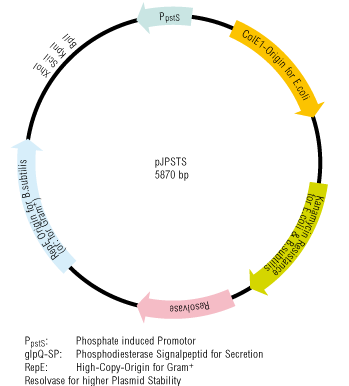
Funktionelle Analyse und Stammoptimierung industriell relevanter Bacilli
Bacillus subtilis gehört zu den am besten untersuchten Bakterien und ist vor allem für die Fähigkeit bekannt, unter extremen Umweltbedingungen metabolisch inaktive Sporen als Überdauerungsform zu bilden. Zusätzlich ist B. subtilis einMeister in der Ausbildung weiterer differenzierter Zelltypen, welche bei der Beweglichkeit, der Biofilmbildung oder der Aufnahme freier DNA aus der Umgebung eine wichtige Rolle spielen. Neben dieser Zelldifferenzierung sind Bacilli in der Lage, große Mengen biotechnologisch relevanter Substanzen zu sekretieren, weshalb Vertreter wie z.B. B. subtilis oder B. licheniformis für die industrielle Produktion von Vitaminen, Enzymen oder Sekundärmetaboliten unverzichtbar geworden sind.